LEY DE LOS GASES
Las primeras leyes de los gases fueron
desarrolladas desde finales del siglo XVII, cuando los científicos empezaron a darse cuenta de
que en las relaciones entre la presión, el volumen y la temperatura de una muestra de gas,
en un sistema cerrado,
Las principales leyes que rigen el estado gaseoso son:
a) Ley de Boyle – Mariotte
b) Ley de Jacques Charles I y
II
c) Ley de Gay Lussac
d) Ley Combinada – Ecuación
general
e) Ley de Dalton
LEY DE BOYLE MARIOTTE
LEY DE BOYLE.
La Ley de Boyle-Mariotte (o Ley de Boyle), formulada por Robert
Boyle y Edme Mariotte, es una de las leyes de los gases ideales que relaciona
el volumen y la presión de una cierta cantidad de gas mantenida a temperatura
constante. La ley dice que el volumen es inversamente proporcional a la presión: PV= K
Donde K es constante si la temperatura y la
masa del gas permanecen constantes.
Cuando aumenta la presión, el volumen
disminuye, mientras que si la presión disminuye el volumen aumenta. El valor
exacto de la constante k no es necesario conocerlo para poder hacer uso de la
Ley; si consideramos las dos situaciones de la figura, manteniendo constante la
cantidad de gas y la temperatura, deberá cumplirse la relación:
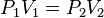
Además se obtiene despejada que:
Donde:
EJERCICIOS:
- Si 758 litros de cloro soporta una presión de 1 atm. Y 20 mm Hg ¿Cuál será el volumen si la presión varía a 2 atm y 8 mm Hg?
- Un volumen de Helio equivale a 1840 litros soportan una presión de 5 atmósferas ¿Cuál será el volumen si la presión varía a 120 libras por pulgada cuadrada, la temperatura permanece constante?
- Un volumen de 12 litros soporta una presión de 1,2 atm ¿Cuál será el volumen si la presión aumenta a 1,8 atm?
LEY DE CHARLES I
Cuando
la presión se mantiene constante, los volúmenes de los gases son directamente
proporcionales a las temperaturas ABSOLUTAS”, es decir, que si la temperatura
aumenta, el volumen también aumenta.
Esta ley se fundamenta en que todo cuerpo por acción del calor se
dilata.
- Un volumen de Hidrógeno igual a 750 ml están a 17°C. Si el volumen a cambiado a 982 ml. Cuál fue la temperatura que actúo suponiendo que la presión no varía.
- Una masa de Nitrógeno ocupa 200 ml a 100°C. Cuál es el volumen a 0°C, permaneciendo
- Un gas tiene un volumen de 2.5 L a 25 °C. ¿Cuál será su nuevo volumen si bajamos la temperatura a 10 °C?
- Inflas un globo con 950 ml de aire a 295 K. Si calientas el aire a 310 K, Cuál es el volumen
- Una muestra de gas tiene un volumen de 80 ml a 50ºC. ¿Qué volumen ocupará la muestra a 0ºC, si la presión se mantiene constante así como la masa de gas.
LEY DE CHARLES II
Como
principio fundamental se tiene que una molécula de cualquier gas que se
encuentre a cero grados centígrados y una atmósfera de presión ocupa el volumen
de 22,4 litros al cual se lo llama “volumen molar”. Es necesario recordar que las masas
moleculares de las moles de los diferentes gases son diferentes pero el volumen
es igual para todos ellos
EJERCICIOS:
- Calcular el volumen que ocupa 1 mol de oxígeno (O2) a 10°C
- Qué volumen ocupa un mol de Oxígeno (O2) a -273°C
- Cuál será el volumen que ocupará 5 moles de CO2 a 30°C
- Cuál será el volumen que ocupará 3 moles de CO2 a 23°C
- Qué volumen ocupará 88 gramos de CO2 a 30°C
- Qué volumen ocupará 34 gramos de N2 a 22°C
- Qué volumen ocupará 28 gramos de H2 a 18°C
- Cuál será el volumen que ocupará 2 moles de N2 a 13°C
LEY DE GAY - LUSSUAC
“Cuando
el volumen se mantiene constante, las presiones que ejercen los gases son
directamente proporcionales a sus temperaturas ABSOLUTAS”, de manera que si la
temperatura aumenta, la presión también aumenta.
EJERCICIOS:
- Una masa gaseosa se encuentra a 18°C y ejerce una presión de 45 atm. Cuál será la presión si la temperatura disminuye a -5°C
- Una lata vacía de aerosol de 200 mL contiene gas a 585 mm de Hg y a 20°C ¿Cual es la presión que se genera en su interior cuando se incinera en una fogata a 700°C?
- A presión de 17 atm, 34 L de un gas a temperatura constante experimenta un cambio ocupando un volumen de 15 L ¿Cuál será la presión que ejerce?
- Cuando un gas a 85º C y 760 mm Hg, a volumen constante en un cilindro, se comprime, su temperatura disminuye a 28,34°C ¿Qué presión ejercerá el gas?
LEY COMBINADA:
La ley
general de los gases o ley combinada dice que una masa de
un gas ocupa un volumen que está determinado por
la presión y la temperatura de dicho gas. Estudia el
comportamiento de una determinada masa de gas si ninguna de esas magnitudes
permanece constante.
Esta ley se emplea para todos aquellos
gases ideales en los que el volumen, la presión y la temperatura no son
constantes. Además la masa no varía. La fórmula de dicha ley se expresa: (V1
* P1) / T1 = (V2 * P2) / T2 Es
decir, el volumen de la situación inicial por la presión original sobre la
temperatura es igual a el volumen final por la nueva presión aplicada sobre la
temperatura modificada.
La
presión es una fuerza que se ejerce por la superficie del
objeto y que mientras más pequeña sea ésta, mayor presión habrá
A partir de la ley combinada podemos calcular la forma como cambia el volumen o presión o temperatura si se conocen las condiciones iniciales (Pi,Vi,Ti) y se conocen dos de las condiciones finales (es decir, dos de las tres cantidades Pt, Vt, Tf).
A partir de la ley combinada podemos calcular la forma como cambia el volumen o presión o temperatura si se conocen las condiciones iniciales (Pi,Vi,Ti) y se conocen dos de las condiciones finales (es decir, dos de las tres cantidades Pt, Vt, Tf).

ECUACIÓN GENERAL
P = presión
V = volumen
N = número de moles = Pa = (Peso en gramos del gas)
Ma
(Peso molecular del gas)
T = Temperatura en grados Kelvin
R = Constante universal de los gases = 0.082 at – li
mol . K
LEY DE DALTON
“La presión total de una mezcla de dos o más gases que no
reaccionan entre sí es igual a la suma de las presiones de los componentes”
http://aprendequimica.blogspot.com/2010/10/ley-de-boyle.html
http://quimica11ddb.blogspot.com/2011/05/ley-combinada-de-los-gases.html
http://quimica11ddb.blogspot.com/2011/05/ley-combinada-de-los-gases.html
Diapositivas: QUIMICA

No hay comentarios:
Publicar un comentario